1. キラリティ(鏡像異性)の基本概念
鏡に映したとき鏡像と実像が一致しない分子をキラルな分子と呼び、このような性質をキラリティと言います[1]。分子に限らず、私たちの右手と左手も互いに実像と鏡像の関係にあるのでキラルと言えます。
互いに鏡像関係にあるペアをエナンチオマー(対掌体)と呼びますが、エナンチオマーどうしの融点や沸点は同じなので、エナンチオマーを区別することはとても難しいのです。ところが、私たちのからだは、一方のエナンチオマーともう一方のエナンチオマーを見分けることができます[2]。
たとえば、キラルな甘味料であるアスパルテームのエナンチオマーは苦いということが知られており、私たちの舌はエナンチオマーを区別できるということがわかります。
同様にキラルな医薬品も、どちらか一方のエナンチオマーの方は効果が高く、もう一方はほとんど効果がない、ということがしばしば起こります。2019年時点で、市販され治療に使用されている医薬品の約56%はキラル化合物であり、そのうち88%はラセミ体(エナンチオマーどうしの混合物)として投与されています[3]。
このようにエナンチオマーのペアのうちの一方を利用するとき、まずは、それぞれのエナンチオマーを区別する必要があります。先に述べましたように、融点や沸点が同じで区別するのが難しいエナンチオマーどうしを、舌を使ったりせずに区別するにはどうしたらよいでしょう。
いくつかの方法がありますが、その一つが、X線を使った絶対配置の決定になります。この方法を使えば、分子の三次元的な構造が目でみてわかりますので、エナンチオマーどうしを区別する(絶対配置を決定する)ことが簡単にできます。
従来は、分子を単結晶化させる必要があり、結晶化が成功しないと絶対配置が決定できないという問題点がありました。しかし、microED技術によって単結晶化の工程を必要とせずに絶対配置が決定できるようになりました。
2.キラル分子の動力学的リファインメントの原理と実績
単結晶X線回折法では、「異常散乱(anomalous scattering)」を利用して分子構造の絶対配置を決定します。原子中の電子を自由電子として扱うと、X線に対する散乱因子はf₀と表され、散乱波と入射波の位相差は一定(π)になります。
しかし、実際の原子では電子の束縛状態が異なるため、外殻電子の散乱能力は自由電子とは異なり、位相角にずれ(ドリフト)が生じます。この現象は波長依存性があり、これを異常散乱と呼びます。
一方で、MicroED(微小電子回折)では、動力学的リファインメント(dynamic refinement)を通じて、分子の絶対配置を決定します。X線に比べて電子は波長が短く、かつ物質との相互作用が非常に強いため、X線回折では解析困難なナノスケールの結晶材料の研究に適しています。ごく小さな領域でも強い電子回折が得られるため、微小・ナノ領域における結晶相の解析や識別に特に有効です。
しかしこの強い相互作用によって、透過型電子顕微鏡(TEM)で取得される回折パターンには強い動力学的効果(複雑な多重散乱)が現れるため、逆に構造解析の妨げとなることもあります(図1参照)。
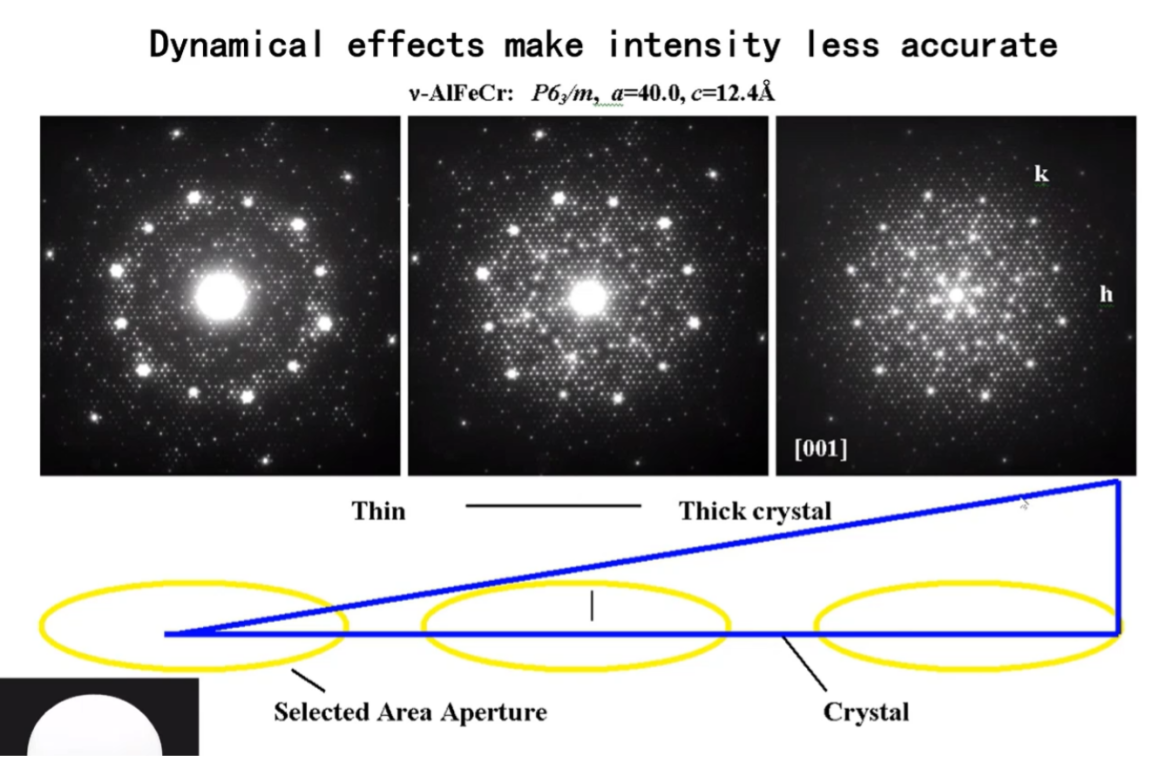
図1:試料の厚さによって引き起こされる顕著な動力学的効果
キラル構造においては、同じ化合物でも鏡像異性体(対掌体)では、動力学的効果に明確な差異が現れます。キラル化合物の相対配置を決定する際には、これらの動力学的効果の違いを利用して、動力学的リファインメントを通じて絶対配置を確認することが可能です。
- まず、データ収集の段階において、Precession Electron Diffraction(PED、プリセッション電子線回折分析)を導入することで、回折パターンにおける動力学的効果の影響を平均化することができます(図2参照)。
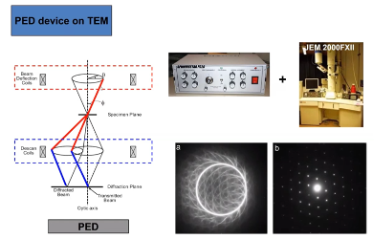
図2:PED(プリセッション電子線回折分析)の動作原理の模式図
- 次に、結晶の厚さ、モザイク性、湾曲、欠陥など、動力学的効果に大きく関わる要因を考慮しながら、データ処理の過程においては、ダブルハンプ図(double-hump diagram)における回折点強度の積分に基づいて、動力学的リファインメントに適した回折データを選別します。
- 最後に、選別された回折データを用いて、異なるキラリティ(鏡像異性)をもつ化合物を個別にリファインメントします。両者の差異を比較することで、未知のキラル化合物の絶対配置を容易に特定することができます。以下に動力学的リファインメントによって絶対配置が決定された75の成功事例をご紹介します(表1参照)。
絶対配置リファインメントの成功事例一覧(ReadCrystal社)
| CAS Number | Name | Molecular Formula | Non-hydrogen Atoms |
| 68-41-7 | D-Cycloserine | C3H6N2O2 | 7 |
| 339-72-0 | L-Cycloserine | C3H6N2O2 | 7 |
| 73-32-5 | L-Isoleucine | C6H13NO2 | 9 |
| 56-85-9 | L-Glutamine | C5H10N2O3 | 10 |
| 464-49-3 | D(+)-Camphor | C10H16O | 11 |
| 464-45-9 | (-)-Borneol | C10H18O | 11 |
| 2216-51-5 | (1R,2S,5R)-(-)-Menthol | C10H20O | 11 |
| 616-91-1 | N-Acetyl-L-Cysteine | C5H9NO3S | 10 |
| 26016-98-8 | Fosfomycin calcium | C3H5O4PCa | 9 |
| 26016-99-9 | Fosfomycin Disodium Salt | C3H5Na2O4P | 10 |
| 66-84-2 | D(+)-Glucosamine hydrochloride | C6H13NO5·HCl | 13 |
| 13189-98-5 | Fudosteine | C6H13NO3S | 11 |
| 87-89-8 | Inositol | C6H12O6 | 12 |
| 6284-40-8 | N-Methyl-D-glucamine | C7H17NO5 | 13 |
| 61-76-7 | (R)-(-)-Phenylephrine hydrochloride | C9H13NO2·HCl | 13 |
| 73-22-3 | L-Tryptophan | C11H12N2O2 | 16 |
| 81-13-0 | D-Panthenol | C9H19NO4 | 14 |
| 51146-56-6 | (S)-(+)-Ibuprofen | C13H18O2 | 15 |
| 72432-03-2 | Miglitol | C8H17NO5 | 14 |
| 1119-34-2 | L-Arginine hydrochloride | C6H14N4O2·HCl | 13 |
| 555-30-6 | 3-(3,4-Dihydroxyphenyl)-2-methyl-L-alanine Sesquihydrate | C10H13NO4 | 15 |
| 7481-89-2 | 2′,3′-Dideoxycytidine | C9H13N3O3 | 15 |
| 104632-26-0 | Pramipexole | C10H17N3S | 14 |
| 69308-37-8 | (R)-Baclofen | C10H12ClNO2 | 14 |
| 62571-86-2 | Captopril | C9H15NO3S | 14 |
| 527-07-1 | D-Gluconic acid sodium salt | C6H11NaO7 | 14 |
| 3056-17-5 | Stavudine | C10H12N2O4 | 16 |
| 6902-77-8 | Genipin | C11H14O5 | 16 |
| 68373-14-8 | Sulbactam | C8H11NO5S | 15 |
| 69655-05-6 | Didanosine | C10H12N4O3 | 17 |
| 96020-91-6 | Eflornithine hydrochloride hydrate | C6H12F2N2O2·HCl·H2O | 14 |
| 5080-50-2 | O-Acetyl-L-carnitine hydrochloride | C9H17NO4·HCl | 15 |
| 16595-80-5 | Levamisol hydrochloride | C11H12N2S·HCl | 15 |
| 867-81-2 | Sodium D-Pantothenate | C9H16NNaO5 | 16 |
| 532-03-6 | Methocarbamol | C11H15NO5 | 17 |
| 3424-98-4 | Telbivudine | C10H14N2O5 | 17 |
| 102518-79-6 | (-)-Huperzine A | C15H18N2O | 18 |
| 147-94-4 | Cytosine β-D-arabinofuranoside | C9H13N3O5 | 17 |
| 320-67-2 | 5-Azacytidine | C8H12N4O5 | 17 |
| 36791-04-5 | Ribavirin | C8H12N4O5 | 17 |
| 121808-62-6 | Pidotimod | C9H12N2O4S | 16 |
| 33125-97-2 | Etomidate | C14H16N2O2 | 18 |
| 609799-22-6 | tasimelteon | C15H19NO2 | 18 |
| 50-91-9 | 5-Fluoro-2′-deoxyuridine | C9H11FN2O5 | 17 |
| 143491-57-0 | Emtricitabine | C8H10FN3O3S | 16 |
| 123441-03-2 | Rivastigmine | C14H22N2O2 | 19 |
| 148553-50-8 | Pregabalin | C8H17NO2 | 11 |
| 274901-16-5 | Vildagliptin | C17H25N3O2 | 22 |
| 80433-71-2 | Calcium Levofolinate | C20H21N7O7.Ca | 35 |
| 797-63-7 | D(-)-Norgestrel | C21H28O2 | 23 |
| 366789-02-8 | Rivaroxaban | C19H18ClN3O5S | 29 |
| 162359-55-9 | Fingolimod | C19H33NO2 | 22 |
| 864070-44-0 | Empagliflozin | C23H27ClO7 | 31 |
| 530-43-8 | chloramphenicol palmitate | C27H42Cl2N2O6 | 37 |
| 486460-32-6 | sitagliptin | C16H15F6N5O | 28 |
| 697761-98-1 | Elvitegravir | C23H23ClFNO5 | 31 |
| 137281-23-3 | Pemetrexed | C20H21N5O6 | 31 |
| 641571-10-0 | Nilotinib | C28H22F3N7O | 39 |
| 668270-12-0 | Linagliptin | C25H28N8O2 | 35 |
| 80621-81-4 | Rifaximin | C43H51N3O11 | 57 |
| 66108-95-0 | Iodoethanol | C19H26I3N3O9 | 34 |
| 114-07-8 | Erythromycin | C37H67NO13 | 52 |
| 155213-67-5 | Lopinavir | C37H48N6O5S2 | 50 |
| 1809249-37-3 | Remdesivir | C27H35N6O8P | 42 |
| 84625-61-6 | Itraconazole | C35H38Cl2N8O4 | 49 |
| 117467-28-4 | Cefuroxime Axetil | C25H28N6O7S3 | 41 |
| 50-55-5 | Nifedipine | C33H40N2O9 | 44 |
| 220127-57-1 | Glimepiride | C29H31N7O.CH4O3S | 42 |
| 97682-44-5 | Iletin | C33H38N4O6 | 43 |
| 231277-92-2 | Lapatinib | C29H26ClFN4O4S | 40 |
| 2252403-56-6 | Sotorasib | C30H30F2N6O3 | 41 |
| 64-86-8 | Colchicine | C22H25NO6 | 29 |
| 18531-94-7 | R-1,1''-linked-2-naphthol (R)-(+)-BINOL | C20H14O2 | 22 |
| 602-09-5 | (+/-)-1,1'-linked-2-naphthol, (+/-)-BINOL | C20H14O2 | 22 |
| 76189-55-4 | (R)-(+)-2,2'-Bis(diphenylphosphino)-1,1'-binaphthyl, (R)-BINAP | C44H32P2 | 46 |
また、日本国内においては、東京理科大学の高橋研究グループと共同でCorey–Bakshi–Shibata(CBS)触媒を用いた2′-アミノ-3′-メチルアセトフェノンの不斉還元反応により得られた二級アルコール生成物の絶対配置を決定しました[4]。本研究では、従来法である修正Mosher法に加え、MicroED(マイクロ結晶電子回折)技術を活用することで、極めて微量の結晶試料から構造解析に成功しました[4]。
その結果、予測通りの立体選択性で反応が進行することを実証し、グラムスケールでも高い不斉収率を得ることに成功しました。本成果は、医薬品合成をはじめとするキラル分子開発において、MicroEDを用いた迅速かつ信頼性の高い構造決定法の有用性を示すものです。
参考文献:
- Eliel, E.L.;Wilen, S.H. Stereochemistry of Organic Compounds; John Wiley & Sons: New York, NY, USA, 1994.
- De Camp,W.H. The FDA Perspective on the development of stereoisomers. Chirality 1989, 1, 2–6. https://doi.org/10.1002/chir.530010103
- Singh, M.; Sethi, S.; Bhushan, R. Liquid chromatographic methods for separation, determination, and bioassay of enantiomers of etodolac: A review. J. Sep. Sci. 2019, 43, 18–30. https://doi.org/10.1002/jssc.201900649
- Arita, H.; Tomizawa, T.; Kikukawa, S.; Sakata, H.; Nishimoto, M.; Tabata, H.; Nakamura, K.; Oshitari, T.; Natsugari, H.; Kusumi, T.; Takahashi, H. Determination of the Absolute Configuration of 2′-Amino-3′-methylacetophenone Based on the Modified Mosher and Microcrystal Electron Diffraction Methods. Chem. Pharm. Bull. 2025, 73, 520–525. https://doi.org/10.1248/cpb.c25-00284
※本サイトの内容転載、複製リンクをご希望の場合、株式会社アクセラレート・バイオにご連絡をお願いいたします。